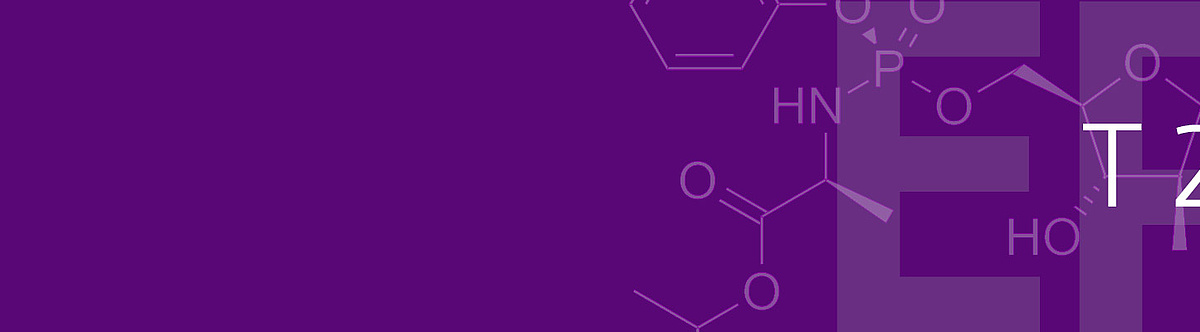
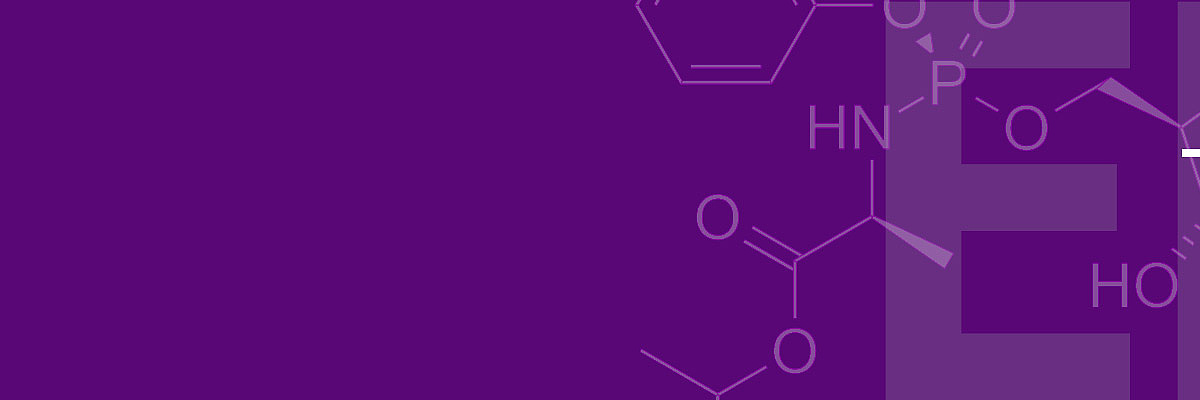

2014 führte Gilead Sciences in der EU „Sofosbuvir“ als neues Medikament ein, dass zu dieser Zeit und auch noch heute das beste Therapieregime für die Behandlung von Hepatitis C. Z.B. in Kombination mit Daclatasvir als weiterem Wirkstoff kann nach einer zwölfwöchigen Therapie eine vollständige Heilung bei über 95 Prozent der Patienten erreicht wird. Dieses Medikament, erregte damals eine relativ starke Kontroverse, da der Hersteller die Rechte zur zu Nutzung des Medikaments durch Übernahme der deutlich kleineren Firma Pharmasset, die den Wirkstoff ursprünglich entwickelt, erworben hatte, und das Medikament zunächst zu einem Einstiegspreis von etwa 700 € pro Tablette und Gesamtbehandlungskosten für eine Behandlung von 12 Wochen von etwa 60.000 € vertrieben wurde. Hier wurde in der Öffentlichkeit ein erhebliches Missverhältnis zwischen den Produktions- und Entwicklungskosten des Wirkstoffs (einige 100 Euro pro Behandlung) und dem durch den Hersteller verlangten Preis gesehen. Es ist daher nicht überraschend, dass eine Reihe von Konkurrenten, aber auch die Organisation Mediciens du Monde, Einspruch gegen das Patent zu diesem Wirkstoff eingelegte.
Zu diesem Einspruch hat die EPA-Beschwerdekammer jetzt eine „vorläufige“ Entscheidung erlassen, nach der das Patent in leicht geänderter Fassung aufrechterhalten werden kann. Diese Entscheidung behandelt zwei Punkte, die als instruktiv für das Verständnis der Bewertung der Offenbarung und der erfinderischen Tätigkeit durch das EPA angesehen werden können:
Der erste Punkt betrifft Änderungen im Erteilungsverfahren (Art. 123 EPÜ), für die das EPA eine unmittelbare und eindeutige Offenbarung fordert. Der Patentinhaber hatte im Rahmen des Erteilungsverfahrens zwei neue abhängige Ansprüche eingeführt, die einzelne Enantiomere (d.h. Verbindungen, die sich nur in der räumlichen Anordnung, aber nicht in der Strukturformel unterscheiden) der in Anspruch 1 beanspruchten Verbindung betrafen. Dabei hatte er sich auf die beschriebene Strukturformel gestützt, die das Racemat (50:50 Gemisch) dieser Enantiomere beschreibt. Jedem Chemiker ist hierzu bewusst, dass ein Racemat ein Gemisch aus den beiden Enantiomeren ist, und es war in der Anmeldung auch beschrieben, dass Racemate der in der Anmeldung beschriebenen Verbindungen durch chromatographische Methoden getrennt werden konnten. Da die ursprüngliche Anmeldung aber eine große Vielzahl an chemischen Verbindungen beschrieb, und die Enantiomere der in den abhängigen Ansprüchen angegebenen Moleküle nicht als solche in der Anmeldung offenbart waren, wertete die Beschwerdekammer diese Beschreibung nicht als ausreichend im Sinne von Art. 123 (2) EPÜ. Dies zeigt einmal mehr, dass das EPA einen photographischen Offenbarungsbegriff anwendet, bei dem nicht als offenbart gilt, was nicht eindeutig beschrieben ist.
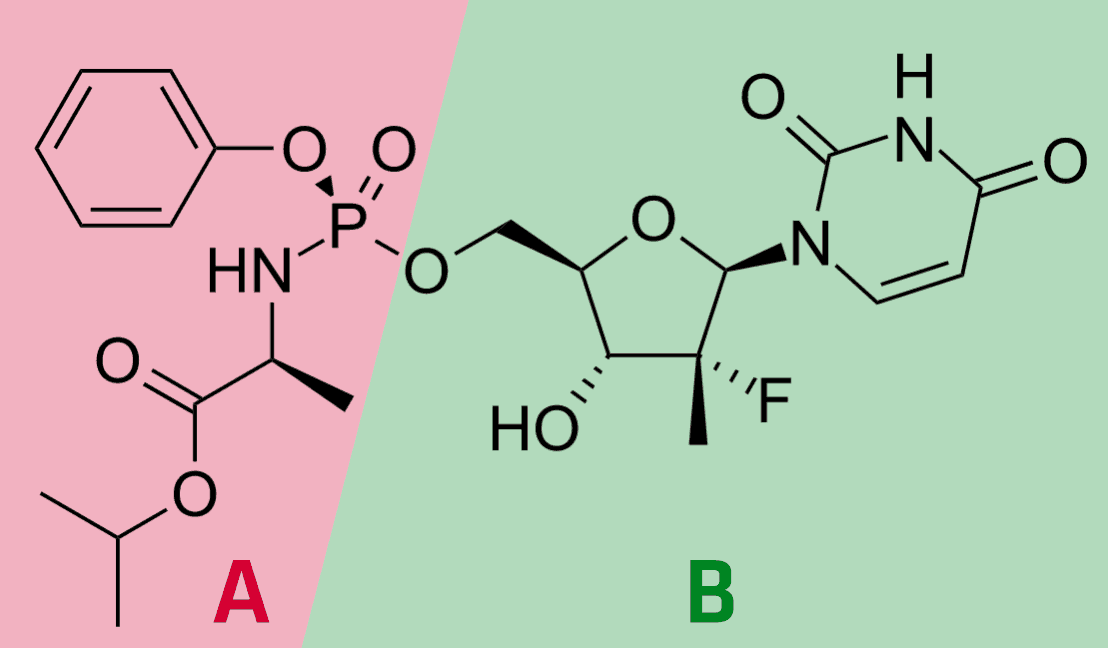
Im zweiten Teil der Entscheidung hat sich die Beschwerdekammer intensiver mit der erfinderischen Tätigkeit auseinandergesetzt, und hier insbesondere die Frage behandelt, unter welchen Umständen die Bewertung dieses Erfordernisses von einer rückschauenden Betrachtungsweise geprägt sein kann. Für die erfinderische Tätigkeit waren die Einsprechenden von mehreren Dokumenten ausgegangen, in denen die Aktivität der Verbindung mit der Struktur B oben gegen Hepatitis C Viren untersucht worden war. Diese Dokumente wurden mit Stand der Technik kombiniert, in denen die Aktivierung von zunächst inaktiven Verbindungen durch Anfügen eines Aryl-Phosphoramidats (A oben) beschrieben war. Durch eine solche Modifikation sollte unter anderem die Zellmembran Permeation verbessert werden, so dass die Verbindung besser in die infizierte Zelle gelangen kann. Die Motivation für eine solche Veränderung sollte sich daraus ergeben, dass die nicht modifizierte Form nicht gegen Hepatitis C wirksam war.
Diese Argumentation wertete die Beschwerdekammer nicht als überzeugend, weil die Informationen zur Nicht-Wirksamkeit der „Verbindung B“ im Stand der Technik, auf den sich die Einsprechenden gestützt hatten, nicht offenbart war, sondern aus einem weiteren Dokument entnommen werden musste. Für eine solche Konstellation sah die Beschwerdekammer daher keine Veranlassung aus dem nächstliegenden Stand der Technik oder aus dem Stand der Technik, der die Modifikation hätte nahelegen können. Um zur patentgemäßen Lösung zu gelangen, hätte der Fachmann die nächstliegende Verbindung über ein weiteres Dokument als nicht ausreichend aktiv erkennen müssen, um dann die im weiteren Stand der Technik beschriebene Modifikation zur Verbesserung der Aktivität in Betracht zu ziehen. Ein solcher zweistufiger Erkenntnisprozess wird von der Beschwerdekammer als Ergebnis einer rückschauenden Betrachtungsweise gesehen.
Die Entscheidung der Beschwerdekammer ist deshalb noch nicht abschließend, weil sich im Einspruch noch eine Fragestellung im Zusammenhang mit der durch das Patent in Anspruch genommenen Priorität ergeben hatte. Hierzu sind derzeit bei der Großen Beschwerdekammer die Vorlagen G 2/21 und G 1/22 anhängig, bis zu deren Entscheidung das weitere Verfahren ausgesetzt wurde. Wenn die große Beschwerdekammer die Rechtmäßigkeit der Inanspruchnahme einer Priorität unter den in T 2643/16 gegebenen Umständen anerkennen sollte, wäre aber mit einer Aufrechterhaltung des Patents im Umfang des erteilten Anspruchs 1 zu rechnen. Aufgrund des außerordentlich hohen Werts des Patents darf das Endergebnis des Beschwerdeverfahrens mit Spannung erwartet werden.